Profesor Luc Montagnier to francuski wirusolog, jeden ze współodkrywców wirusa HIV, za co otrzymał ? wraz z zespołem ? Nagrodę Nobla w 2008 roku. W swoich ostatnich badaniach przeprowadził serię rygorystycznych doświadczeń dotyczących właściwości elektromagnetycznych wysoko rozcieńczonych materiałów biologicznych.

Badania wykazały, że niektóre sekwencje DNA bakterii są w stanie wywołać fale elektromagnetyczne w wysoko rozcieńczonych roztworach wodnych. Wydaje się to być wywołane zjawiskiem rezonansu, spowodowanego przez tło otoczenia elektromagnetycznego o bardzo niskiej częstotliwości fal. Naukowcy wykorzystali roztwory wodne, które zostały pobudzone i stopniowo rozcieńczone (naukowcy podkreślili, że roztwory były "mocno wstrząsane" i że krok ten był "niezbędny dla generowania sygnałów"). Innymi słowy postępowali według zasady homeopatycznego potencjonowania, chociaż słowo "homeopatia" nie jest wymienione w artykule.
Naukowcy odkryli, że chorobotwórcze bakterie i wirusy pozostawiają wyraźny elektromagnetyczny "podpis" w rozcieńczeniach od 10-5 do 10-12 (odpowiadających rozcieńczeniem homeopatycznym od 5D do 12D) i te niewielkie fragmenty DNA (odpowiedzialne za chorobotwórczość) były wyłącznie odpowiedzialne za sygnał elektromagnetyczny. Naukowcy zauważyli również, że w jednym eksperymencie stwierdzono znaczące wyniki w rozcieńczeniu tak wysokim jak 10-18 (odpowiednik rozcieńczenia homeopatycznego 18D). Elektromagnetyczny "podpis" zmieniał się wraz z poziomem rozcieńczenia, ale w stężeniu początkowym pozostawał niezmienny ? nawet po zniszczeniu pozostałych fragmentów DNA przez czynniki chemiczne.
Zauważyli oni również, że sygnał elektromagnetyczny był niszczony podczas ogrzewania lub zamrażania próbki. W badaniu krzyżowym stwierdzono także, że jeśli próbka ujemna zostanie pozostawiona razem z próbką pozytywną na kilka godzin, to próbka ujemna będzie hamowała pozytywny sygnał tej drugiej próbki. Naukowcy uważają, że podczas procesu rozcieńczania pojawiają się w próbkach specyficzne formy nanostruktur wodnych, które są odpowiedzialne za mierzalny efekt oddziaływania elektromagnetycznego.
Naukowcy wykryli również ten sam sygnał elektromagnetyczny w osoczu i w DNA pochodzącym z osocza pacjentów cierpiących na chorobę Alzheimera, chorobę Parkinsona, stwardnienie rozsiane i reumatoidalne zapalenie stawów.
Doświadczenie to stanowi ważny wkład do wciąż rosnącej bazy przeprowadzonych badań potwierdzających działanie homeopatii.
Piśmiennictwo:
Montagnier L, Aissa J, Ferris S, Montagnier J-L, Lavallee C (2009). Electromagnetic Signals Are Produced by Aqueous Nanostructures Derived from Bacterial DNA Sequences. Interdisciplinary Sciences: Computational Life Sciences, 1: 81-90.
Informacje szczegółowe
... dla ciekawych
Luc MONTAGNIER1,2 , Jamal A?SSA1, Stephane FERRIS1,
Jean-Luc MONTAGNIER1, Claude LAVALLEE1
1 (Nanectis Biotechnologies, S.A. 98 rue Albert Calmette, F78350 Jouy en Josas, Francja)
2 (Vironix LLC, L. Montagnier 40 Central Park South, New York, NY 10019, USA)
Otrzymano 3 stycznia 2009 r. / Poprawiono 5 stycznia 2009 r. / Przyjęto 6 stycznia 2009 r.
W obecnych czasach mikroorganizmy patogenne nie tylko są poddawane silnemu naciskowi selektywnemu ze strony układów immunologicznych gospodarzy, lecz także muszą przeżyć w warunkach wysoce aktywnego leczenia przeciwwirusowego lub przeciwbakteryjnego. Nie stanowi zatem zaskoczenia fakt, iż ulegają one ewolucji, znajdując wiele sposobów ominięcia tego typu niekorzystnych warunków, takich jak mutacje zapewniające oporność, wysoka zmienność fragmentów antygenowych, ochronne błony biologiczne, utajone zakażenia komórek i tkanek.
Autorzy (Montagnier i Lavallee, kontakt osobisty) początkowo zaobserwowali, że pewne procedury filtracji mające na celu sterylizację płynów biologicznych mogą powodować przedostawanie się w określonych warunkach mikroorganizmu zakaźnego, który występował przed etapem filtracji. Mianowicie filtracja supernatantu z hodowli limfocytów ludzkich zakażonych prątkiem Mycoplasma pilum ? mikroorganizmem o wielkości około 300 nm, przez filtry o rozmiarze porów 100 nm lub 20 nm, dawała pozornie sterylny płyn. Płyn ten był jednak w stanie w okresie 2?3 tygodni odtworzyć oryginalne prątki po inkubacji z niezawierającą prątków hodowlą limfocytów ludzkich.
Podobnie filtracja przez filtr 20 nm nie zatrzymuje niewielkiej zakaźnej frakcji wirusa HIV ? czynnika wywołującego AIDS ? którego cząsteczki mają średnicę 100?120 nm.
W trakcie badań nad takimi formami zachowującymi zakaźność po przefiltrowaniu autorzy odkryli kolejną właściwość przesączów, która może być związana z wcześniejszą obserwacją: są one w stanie wytwarzać pewne fale elektromagnetyczne o niskiej częstotliwości w powtarzalny sposób po odpowiednim rozcieńczeniu w wodzie. Emisja takich fal prawdopodobnie stanowi zjawisko rezonansu zależnego od wzbudzenia przez szum elektromagnetyczny w otoczeniu. Jest to związane z obecnością rozcieńczeń wodnych polimerowych nanostruktur o określonych rozmiarach. Supernatant z niezakażonych komórek eukariotycznych, zastosowany w charakterze kontroli, nie wykazuje takich właściwości.
W niniejszej pracy przedstawiono charakterystykę sygnałów elektromagnetycznych (EMS) oraz będących ich źródłem nanostruktur wytwarzanych przez pewne oczyszczone bakterie.
Oprócz M. pilum w przeprowadzonej analizie wykorzystano także bardziej klasyczną bakterię ? E. coli. Nanostruktury wytwarzane przez wirus HIV będą przedmiotem osobnej pracy.
M. pirum jest niewielką komórką bakteryjną w kształcie gruszki, przypominającą M. pneumoniae, którą można hodować na syntetycznym podłożu wzbogaconym (SP4) (Tully i wsp., 1977), lecz która namnaża się także na powierzchni ludzkich limfocytów T.
Szczep (Ber) użyty w opisanych eksperymentach wyizolowano z hodowli ludzkich limfocytów T pochodzących z krwi pozornie zdrowej osoby (Grau i wsp., 1993). Silne przyleganie prątków do limfocytów wynika z obecności swoistej adhezyny, której gen autorzy uprzednio sklonowali i poddali sekwencjonowaniu (Tham i wsp., 1994).
Jako główne źródło prątków użyliśmy supernatantów z zakażonych hodowli ludzkich limfocytów T lub hodowli linii limfocytów T guza CEM. Wszystkie hodowle komórek przetestowano najpierw pod kątem niewystępowania skażenia przez M. pirum metodą reakcji łańcuchowej polimerazy (PCR) i metodą zagnieżdżonej PCR przed rozpoczęciem eksperymentów. Miana 106?107 jednostek zakaźnych/ml M. pirum łatwo uzyskano po 5?6 dniach inkubacji po celowym zakażeniu obu typów hodowli.
Filtrację klarownego supernatantu przeprowadzono najpierw przy użyciu filtrów Millipore o średnicy porów 0,45 ?m (450 nm) w celu usunięcia zanieczyszczeń, a następnie przy użyciu filtrów Millipore o średnicy porów 0,1 ?m (100 nm) lub filtrów Whatman o średnicy porów 0,02 ?m (20 nm) w celu usunięcia komórek prątków. Kilkutygodniowa inkubacja próbek pobranych z przesączów 100 ?m i 20 ?m w podłożu SP4 potwierdziła ich sterylność. Wyniki wielokrotnego poszukiwania śladów DNA prątków metodą PCR i zagnieżdżonej PCR przy użyciu swoistych primerów dla genu adhezyny lub genu rybosomów 16S były stale ujemne.
Jednak po inkubacji przesączów przez dwa tygodnie (w przypadku przesączu 100 nm) lub przez trzy tygodnie (w przypadku przesączu 20 nm) z hodowlą aktywowanych ludzkich limfocytów T w podłożu wykryto prątki o wszystkich cechach charakterystycznych obserwowanych wcześniej.
Te same przesącze przeanalizowano bezpośrednio po filtracji pod kątem wytwarzania fal elektromagnetycznych o niskiej częstotliwości. Do tego celu użyto urządzenia zaprojektowanego wcześniej przez Benveniste'a i Colla (1996; 2003) do wykrywania sygnałów wytwarzanych przez izolowane cząsteczki wykazujące aktywność biologiczną. Zasada tej techniki jest przedstawiona na ryc. 1.
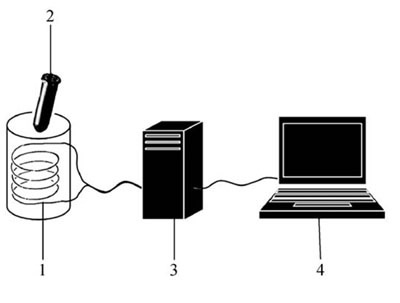
Ryc. 1 Urządzenie do rejestrowania i analizowania sygnałów elektromagnetycznych (EMS): (1) Spirala: cewka z drutu miedzianego o impedancji 300 omów; (2) zamknięta plastikowa probówka zawierająca 1 ml analizowanego roztworu; (3) wzmacniacz; (4) komputer z oprogramowaniem.
W skrócie należy wspomnieć, że przesącze 100 nm lub 20 nm poddawano seryjnym rozcieńczeniom 1 do 10 [0,1 + 0,9 w sterylnej wodzie (o medycznej klasie czystości)]. Pierwsze 2 rozcieńczenia (1/10 i 1/100) wykonywano w niezawierającym surowicy podłożu RPMI w celu uniknięcia ewentualnego wytrącenia białek w wodzie dejonizowanej.
Każde rozcieńczenie wykonano w plastikowej próbówce Eppendorfa 1,5 ml, które następnie szczelnie zamykano i silnie wytrząsano na wytrząsarce typu Vortex przez 15 sekund. Zaobserwowano, że etap ten ma krytyczne znaczenie dla generowania sygnałów.
Po wykonaniu wszystkich rozcieńczeń (zazwyczaj 15?20 rozcieńczeń dziesiętnych) zamknięte probówki badano po kolei w spirali elektromagnetycznej podłączonej do karty Sound Blaster, która z kolei była podłączona do komputera przenośnego, najlepiej zasilanego z wewnętrznego akumulatora 12 woltowego. Każdą emisję rejestrowano dwukrotnie przez 6 sekund, wzmacniano 500 razy i przetwarzano za pomocą różnych programów komputerowych w celu wizualizacji sygnałów na ekranie komputera (ryc. 1).
Główne składowe harmoniczne złożonych sygnałów analizowano przy użyciu różnych programów metodą transformacji Fouriera.
W każdym eksperymencie najpierw rejestrowano szum wewnętrzny generowany przez różne elementy systemu odczytującego (samej spirali, spirali z probówką wypełnioną wodą). Analiza metodą Fouriera wykazała [ryc. 2(c, d)], że szum składa się głównie z bardzo niskich częstotliwości, prawdopodobnie generowanych przynajmniej w części przez występujący w otoczeniu prąd elektryczny 50/60 Hz. Użycie akumulatora 12 V do zasilania komputera zredukowało ten szum, choć nie pozwoliło całkowicie go wyeliminować, co uznano za konieczne do indukcji sygnałów rezonansu pochodzących ze swoistych nanostruktur.
Gdy rozcieńczenia przesączu M. pirum rejestrowano pod kątem emisji fal, pierwszym wyraźnie zaobserwowanym zjawiskiem był wzrost ogólnej amplitudy sygnałów przy określonych rozcieńczeniach ponad szum tła [ryc. 2(a)], jak też wzrost częstotliwości [ryc. 2(b)]. Zmiana ta zanikała, jeżeli analizowaną probówkę umieszczano wewnątrz pudełka wyłożonego arkuszami miedzi i mumetalu (David, 1998).
Analiza sygnałów pochodzących z M. pilum metodą Fouriera wykazała przesunięcie w stronę wyższych częstotliwości zbliżonych do 1000 Hz oraz ich wielokrotności. Profile były identyczne dla wszystkich rozcieńczeń, wykazując wzrost amplitudy [ryc. 2(c) i 2(d)].
Pierwsze niskie rozcieńczenia dawały zazwyczaj wynik ujemny, wykazując jedynie szum tła. Sygnały dodatnie zazwyczaj otrzymywano z rozcieńczeń wynoszących od 10-5 do 10-8 lub 10-12. Wyższe rozcieńczenia ponownie dawały wyniki ujemne (ryc. 3).
Rozcieńczenia dodatnie wykazywały różnice w zależności od typu filtracji, przy czym przesącz 20 nm dawał zazwyczaj wynik dodatni przy rozcieńczeniach wyższych niż w przypadku przesączu 100 nm.
Oryginalna, niefiltrowana zawiesina była ujemna przy wszystkich rozcieńczeniach ? zjawisko to zaobserwowano dla wszystkich badanych mikroorganizmów.
Rozmiar i gęstość struktur wytwarzających sygnały w rozcieńczeniach wodnych:
Porcję przesączu 20 nm umieszczono w postaci warstwy na roztworze wodnym sacharozy o stężeniu 5?20% (masa/obj.) i wirowano przez 2 godziny z prędkością 35 000 obr./min w wirówce z wychylnym gniazdem. Warunki takie stosowano wcześniej do uzyskania równowagi gęstości nienaruszonych komórek prątków, które tworzyły wyraźną granicę przy gęstości 1,21. Pobierano frakcje z dna probówek, łączono je 2 po 2 i oceniano pod kątem emisji sygnałów.
Ryc. 4 przedstawia, że struktury emitujące sygnał były rozmieszczone w różnych zakresach gęstości, od 1,15 do 1,25, jak też wykazywały wysoki współczynnik sedymentacji.
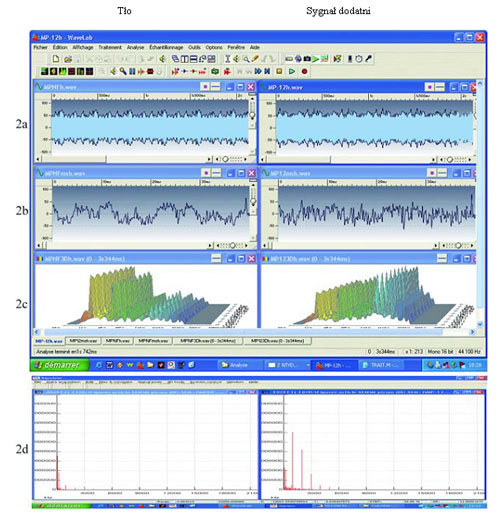
Ryc. 2 Wykrywanie EMS w zawiesinie Mycoplasma pirum: Po lewej: szum tła (z nieprzefiltrowanej zawiesiny lub ujemnego niskiego rozcieńczenia). Po prawej: sygnał dodatni [z wysokiego rozcieńczenia D 7 (10-7)]. (a) rzeczywisty zapis (2 sekundy z 6 sekundowego zapisu) po obróbce w programie WaveLab (Steinberg); (b) szczegółowa analiza sygnału (skala w milisekundach); (c) Analiza z transformacją Fouriera w programie Matlab 3D (oś odciętych: 0?20 kHz, oś rzędnych: natężenie względne, wymiar 3D: rejestrowanie w różnym czasie); częstotliwości są przedstawione różnymi kolorami; (d) transformacja Fouriera w programie Sigview: należy zwrócić uwagę na nowe fale harmoniczne w zakresie 1 000?3 000 Hz.
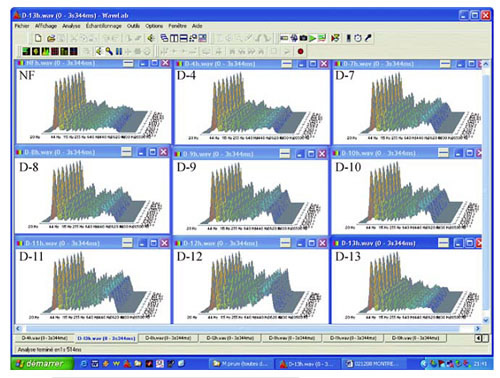
Ryc. 3 Typowy zapis sygnałów z rozcieńczeń wodnych M. pirum (oprogramowanie Matlab): należy zwrócić uwagę na dodatnie sygnały z rozcieńczeń od D 7 do D 12.
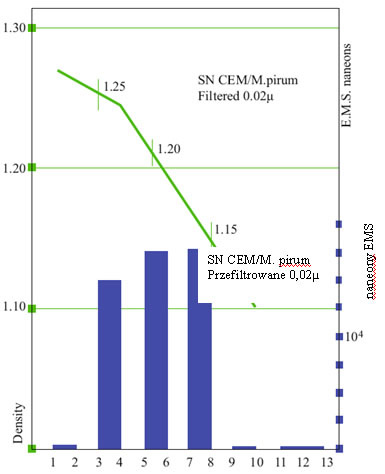
Ryc. 4 Wirowanie przesączu 0,02 ?m zawiesiny Mycoplasma pirum w roztworze sacharozy 35 000 obr./min, 2 godz.). Zebrane frakcje połączono 2 po 2 i wykonano rozcieńczenia do D 15, po czym przetestowano jest pod kątem EMS. Paski wskazują frakcje dodatnie pod względem EMS.
Następnie wykonano badania bardziej klasycznej bakterii ? E. coli ? przy użyciu jej szczepu laboratoryjnego K1.
Hodowla E. coli w warunkach wytrząsania (tlenowego) dała 109 jednostek bakterii/ml, co zmierzono metodą spektrometrii. Następnie zawiesinę odwirowano z prędkością 10 000 obr./min przez 15 minut, po czym supernatant filtrowano przez filtr o średnicy porów 450 nm, a uzyskany przesącz filtrowano ponownie przez filtr o średnicy porów 100 nm. Po posianiu ostatecznego przesączu na podłożu agarowym okazał się on sterylny. Poddano go zatem analizie pod kątem emisji fal elektromagnetycznych, jak opisano powyżej dla M. pirum. Rozcieńczenia dające sygnały zazwyczaj mieściły się w zakresie od 10-8 do 10-12, a ich profile po transformacji Fouriera były podobne do zaobserwowanych w przypadku M. pirum (ryc. 5). W jednym z eksperymentów zaobserwowano dodatni wynik dla bardzo wysokich rozcieńczeń, wynoszących od 10-9 do 10-18. Porcja nieprzefiltrowanego supernatantu nie wykazywała żadnych sygnałów poza tłem do rozcieńczenia 10-38, co ponownie wskazuje na krytyczne znaczenie etapu filtracji dla generowania swoistych sygnałów.
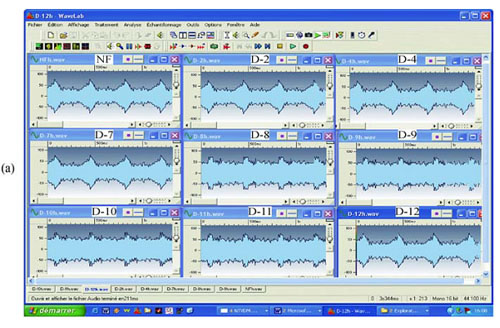
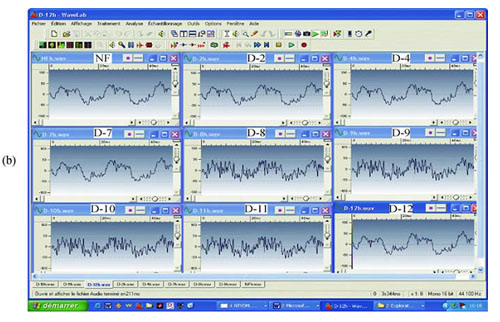
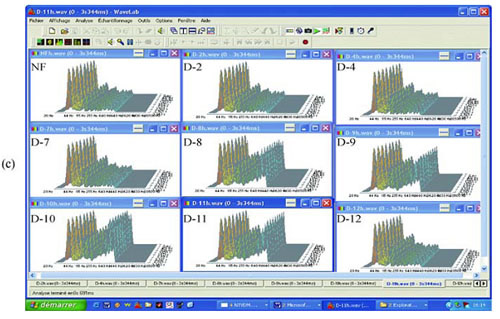
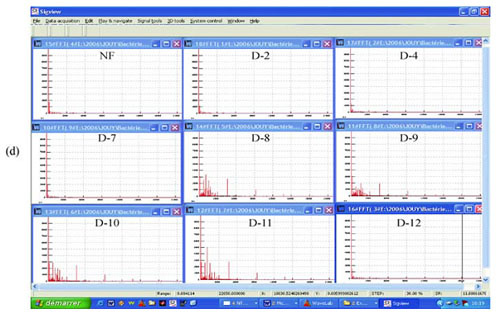
Ryc. 5 EMS z przesączu 0,1 ?m E. coli. Dodatnie EMS z rozcieńczeń od D 8 do D 11: (a) rzeczywisty zapis; (b) analiza milisekundowa; (c) analiza z transformacją Fouriera w oprogramowaniu Matlab; (d) analiza z transformacją Fouriera w oprogramowaniu SigView. NF: niefiltrowane.
Jedyną różnicą w odniesieniu do M. pirum było to, że żaden sygnał nie pojawił się po filtracji przez filtry o średnicy porów 20 nm, co sugeruje, że struktury związane z sygnałami zostały zatrzymane przez te filtry, w związku z czym ich rozmiar jest większy od 20 nm i mniejszy od 100 nm.
Następnie autorzy zadali sobie pytanie, dlaczego niższe rozcieńczenia, które na logikę powinny zawierać większą liczbę struktur wytwarzających sygnały, były "ciche". Po dodaniu 0,1 ml ujemnego, niskiego rozcieńczenia (np. 10-3) do 0,4 ml lub 0,9 ml rozcieńczenia dodatniego (10-8), wówczas to drugie rozcieńczenie stawało się ujemne. Sugeruje to, że "ciche" niskie rozcieńczenia wykazują właściwości autohamujące, prawdopodobnie na skutek interferencji wielu źródeł emitujących falę o tej samej długości lub z niewielkim przesunięciem fazy, podobnie jak przy zakłócaniu fal radiowych. Alternatywna hipoteza może być taka, że nadmiar nanostruktur może tworzyć żel w wodzie, zapobiegając jego wibracjom.
Dowody na homologiczne "porozumiewanie się" pomiędzy rozcieńczeniami
Następnie autorzy postanowili sprawdzić, czy możliwe jest wygenerowanie nowych struktur emitujących sygnały z probówki do probówki poprzez transfer fal. Opisany poniżej eksperyment, który powtórzono kilkakrotnie, wykazał, iż faktycznie jest to możliwe.
Probówkę źródłową, zawierającą niskie, "ciche" rozcieńczenie E. coli (10-3) umieszczono obok probówki docelowej, zawierającej najwyższe dodatnie, "głośne" rozcieńczenie tego samego preparatu (10-9). Obie probówki umieszczono w pudełku z mumetalu na 24 godziny w temperaturze pokojowej, tak aby nie były one narażone na zewnętrzny szum elektromagnetyczny, a tylko na sygnały generowane przez struktury występujące w samych probówkach.
Następnie probówki ponownie zbadano przy użyciu urządzenia wykrywającego sygnały: probówka źródłowa nadal pozostawała "cicha", jednak probówka docelowa także stała się "cicha".
Co więcej po wykonaniu dalszych rozcieńczeń z probówki docelowej (10-10, 10-11, 10-12), rozcieńczenia te stały się dodatnie (ryc. 6). Wyniki te sugerują, że probówka docelowa stała się "cicha" przez wytworzenie nadmiaru nowych nanostruktur, które odzyskały zdolność emitowania sygnałów po dalszym rozcieńczeniu.
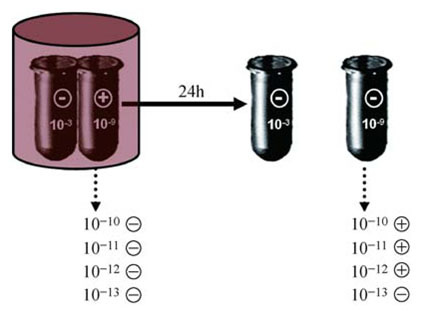
Ryc. 6 Wzajemna komunikacja pomiędzy rozcieńczeniami (z przesączu 0,1 ?m E. coli) ? patrz wyjaśnienia w tekście.
Efekt ten był hamowany przez umieszczenie arkusza mumetalu pomiędzy obydwoma probówkami w 24 godzinnym okresie kontaktu, co wskazuje na rolę fal o niskiej częstotliwości w powstawaniu tego zjawiska.
Emisję podobnych sygnałów elektromagnetycznych zaobserwowano także w przypadku niektórych innych gatunków bakterii, takich jak: paciorkowce z grupy B, Staphylococcus aureus, Pseudomonas aeruginosa, Proteus mirabilis, Bacillus subtilis, Salmonella, Clostridium perfringens ? we wszystkich przypadkach w takim samym zakresie rozcieńczeń jak w przypadku E. coli oraz tylko po przefiltrowaniu przez filtr o średnicy porów 100 nm (a nie 20 nm).
Co ważne efekt transferu pomiędzy dwoma probówkami, z których jedna jest "cicha", a druga "głośna", zaobserwowano tylko w przypadku, gdy obie probówki zawierają rozcieńczenia tego samego gatunku bakterii. Innymi słowy, probówka źródłowa zawierająca Staphylococcus jest w stanie "komunikować się" tylko z probówką docelową, która także zawiera rozcieńczenie Staphylococcus, a nie z probówką zawierającą Streptococcus lub E. coli i vice versa.
Wyniki te wskazują na to, że efekt przenoszenia jest uzależniony od sygnałów swoistych dla danego gatunku ? częstotliwości, które należy przeanalizować.
Wreszcie w układzie z E. coli zbadano dwa inne problemy: pierwszym z nich była rola wyjściowej liczby komórek bakteryjnych dla wprowadzania przechodzących przez filtr struktur wytwarzających sygnały. W tym celu stacjonarną hodowlę E. coli zliczono i skorygowano na 109 komórek/ml, a następnie wykonano seryjne rozcieńczenia od 100 na 100 do 1 komórki/ml. Każde rozcieńczenie przefiltrowano przez filtr 100 nm, a następnie poddano analizie pod kątem emisji sygnałów. Zaskakujący jest fakt, iż zakres rozcieńczeń dodatnich nie był ściśle uzależniony od wyjściowego stężenia komórek E. coli i wynosił w przybliżeniu tyle samo dla różnej liczby komórek, od 109 do 10 komórek, co sugeruje, że taką samą końcową liczbę nanostruktur uzyskiwano przy wszystkich stężeniach. A zatem ? paradoksalnie ? 10 komórek daje takie same sygnały jak 109 komórek.
Autorzy obawiali się także o potencjalny błąd wynikający z osobistego udziału operatora w odczycie.
Aby rozwiązać ten problem, poproszono dwóch zdrowych operatorów o wykonywanie niezależnych pomiarów dla takich samych rozcieńczeń E. coli, przy czym żaden z nich nie znał wyniku określonego przez drugiego operatora. Wyniki wykonanych przez nich odczytów były identyczne.
Ponadto wyniki były niezależne od kolejności odczytywania próbek ? malejącej od najniższego do najwyższego rozcieńczenia, bądź rosnącej od najwyższego do najniższego rozcieńczenia.
Wreszcie inny pracownik laboratorium ustawił rozcieńczone próbki w kolejności losowej, przy czym oznakowanie nie było znane osobie wykonującej odczyt próbek. Ponownie stwierdzono taki sam zakres rozcieńczeń dodatnich pod warunkiem, że każda probówka była oddzielona od innych w celu uniknięcia "komunikowania się".
Autorzy zaobserwowali także, że wyniki były niezależne od lokalizacji miejsca wykonywania odczytu: rozpoczynając od tego samego, niefiltrowanego preparatu E. coli, stwierdzono takie same dodatnie rozcieńczenia przesączów w dwóch różnych lokalizacjach we Francji (Paryż i jego przedmieścia), jednej w Kanadzie (Montreal) i jednej w Kamerunie (Jaunde).
Jak przedstawiono na rycinach, szum tła był zmienny i uzależniony od lokalizacji i godziny rejestrowania. Był on ogólnie wyższy w dużych miastach niż w obszarach izolowanych. Jednak sygnały dodatnie zawsze wyraźnie odróżniały się od tła wyższymi pikami częstotliwości.
Charakter nanostruktur wodnych:
Obróbka z zastosowaniem preparatów RNAzy A (Promega, 1 ?g/ml, 37oC 1 h), DNAzy I (Invitrogen, 10 U/?g DNA, 37oC,18 h), lizozymu (Fisher, 1 mg/ml, 37oC 10 min), proteinazy K (Promega, 0,12 mg/ml, w 1% dodecylosiarczanie sodu, 56oC, 1 h) nie znosiła aktywności generowania EMS "głośnych" rozcieńczeń ani też nie aktywowała "cichych" rozcieńczeń.
Jednak ogrzewanie w temperaturze 70oC przez 30 min nieodwracalnie hamowało tę aktywność, podobnie jak zamrożenie na 1 godz. w temperaturze -20oC lub -60oC. DMSO (10%) i formamid (10%) nie wykazywały żadnego działania.
Obróbka z zastosowaniem kationów litu, o których wiadomo, że mają wpływ na wiązania wodorowe w cząsteczkach wody, była w stanie zredukować intensywność sygnałów, natomiast zakres rozcieńczeń dodatnich pozostał niezmieniony.
Charakter cząsteczek bakteryjnych, z których wywodzą się nanostruktury:
We wstępnych eksperymentach zaobserwowaliśmy, że wstępna obróbka zawiesiny E. Coli z zastosowaniem 1% formaldehydu zabijała bakterie, lecz nie zmieniała zdolności zawiesiny do indukowania sygnałów elektromagnetycznych. Obróbka taka zmienia powierzchnię białek komórek bakteryjnych bez atakowania ich materiału genetycznego, tj. podwójnej helisy DNA. Sugeruje to, że źródłem tych sygnałów może być samo DNA.
I rzeczywiście ? DNA wyekstrahowane z zawiesiny bakteryjnej klasyczną techniką fenol: chloroform po przefiltrowaniu i odpowiednim rozcieńczeniu w wodzie było w stanie emitować EMS podobne do obserwowanego po zastosowaniu całych komórek bakteryjnych w takich samych warunkach. Obróbka roztworu wyekstrahowanego DNA przy użyciu DNAzy eliminuje jego zdolność do emitowania sygnałów, co wskazuje na to, że nanostruktury wcześniej indukowane przez DNA ulegają zniszczeniu. Typowy eksperyment opisano następująco:
DNA pochodzące z E. coli poddano obróbce proteinazą K w obecności SDS (dodecylosiarczan sodu), a następnie deproteinizacji mieszaniną fenolu i chloroformu. Grudkę uzyskaną w wyniku precypitacji w etanolu zawieszono w roztworze Tris 10 2 M, pH 7,6, a porcję uzyskanej zawiesiny rozcieńczono wodą w stosunku 1/100. Rozcieńczenie (10-2) przefiltrowano najpierw przez filtr o średnicy porów 450 nm, a następnie uzyskany przesącz przefiltrowano ponownie przez filtr o średnicy porów 100 nm. Z uzyskanego przesączu wykonano dalsze rozcieńczenia dziesiętne w wodzie, jak opisano poprzednio.
Podobnie jak w przypadku całych mikroorganizmów, zaobserwowano, że etap filtracji ma zasadnicze znaczenie dla wykrywania EMS w rozcieńczeniach DNA. Gdy etap ten pomięto, nie zaobserwowano sygnałów w żadnym rozcieńczeniu.
W odróżnieniu od zawiesiny mikroorganizmów, gdzie filtracja miała zatrzymać całe komórki, filtracja przez filtr o średnicy porów 100 nm nie zatrzymuje DNA, które nadal jest obecne w przesączu, co można określić na podstawie gęstości optycznej. Jednak filtracja przy użyciu filtra Whatman o średnicy porów 20 nm zatrzymuje nanostruktury emitujące EMS, co sugeruje, że ich zakres rozmiarów jest taki sam jak w przypadku struktur pochodzących z całych bakterii.
W przypadku DNA rolą filtracji przez filtr o średnicy porów 100 nm jest prawdopodobnie rozpad sieci nanostruktur zorganizowanych w postaci płynnego kryształu przypominającego żel w wysokich stężeniach w wodzie, co umożliwia ich dyspersję w dalszych rozcieńczeniach. Jak przedstawia ryc. 7, rozcieńczenia dodatnie pod względem EMS pozostawały w takim samym zakresie, jaki zaobserwowano w przypadku całych bakterii ? zazwyczaj od 10-7 do 10-13. Dla wysokiego rozcieńczenia 10-13 obliczenia wykazały, że w roztworze nie występują cząsteczki DNA o masie cząsteczkowej (MW) przekraczającej 105, co zmniejsza prawdopodobieństwo tego, że EMS są generowane przez samo DNA, lecz raczej przez samopodtrzymujące się nanostruktury indukowane przez DNA.
Ogólnie rzecz biorąc, ze wszystkich gatunków bakterii, dla których wykazano dodatnie wyniki badania EMS, można także uzyskać preparaty DNA dodatnie pod względem EMS. Fakt, iż EMS wytwarzane przez bakterie pochodzą z ich DNA, znajduje potwierdzenie w obserwacji dotyczącej ich zanikania po obróbce DNAzą.
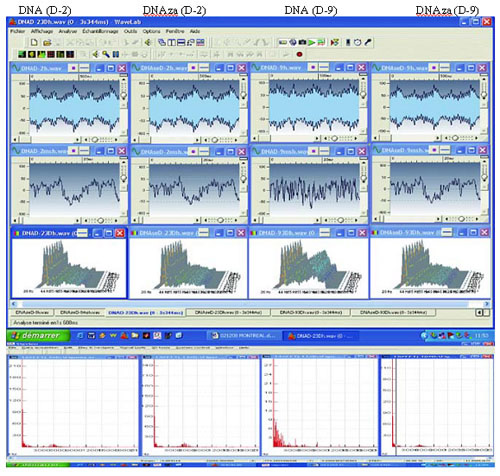
Ryc. 7 Wpływ DNAzy na generowanie EMS. Wykonano rozcieńczenia od D 2 do D 15 roztworu DNA E. coli poddanego obróbce DNAzą oraz DNA niepoddanego obróbce. Analiza EMS tak jak opisano na ryc. 5. Rozcieńczenie D 2 (ujemne pod względem EMS) jest przedstawione jako kontrola. W rozcieńczeniu D 9 występują EMS (zakres rozcieńczeń dodatnich od D 8 do D 11). Należy zwrócić uwagę na zanik sygnału w DNA poddanym obróbce DNAzą.
Inaktywacja ta była jednak pełna tylko po wcześniejszym całkowitym zniszczeniu nanostruktur indukowanych w roztworze DNA, które same są odporne na DNAzę.
Można tego dokonać, zamrażając roztwór DNA w temperaturze -20oC na 1 godzinę bądź podgrzewając go do 90oC przez 30 minut.
Po powolnym ochłodzeniu w celu umożliwienia odzyskania struktury przez podgrzane DNA, do mieszaniny dodano DNAzę 1 w końcowym stężeniu 10 U/?g DNA i prowadzono inkubację w 37oC przez 18 godzin w obecności 5 mM MgCl2. Porcję niepoddanego obróbce roztworu DNA zachowano jako kontrolę dodatnią.
Zaobserwowano, że preparat poddany obróbce DNAzą jest całkowicie pozbawiony emisji EMS w dowolnym rozcieńczeniu (ryc. 7).
Poddanie roztworu DNA działaniu enzymu restrykcyjnego działającego na wiele miejsc w DNA E. coli (EcoRV) nie hamowało wytwarzania EMS, co sugeruje, że emisja ta jest związana z raczej krótkimi sekwencjami lub jest związana z rzadko występującymi sekwencjami.
Charakter sekwencji DNA odpowiedzialnych za powstawanie EMS:
Niewyczerpujący przegląd gatunków bakterii oraz ich DNA, które jest w stanie generować EMS, sugeruje, że do kategorii tej należy większość bakterii będących patogenami ludzkimi.
Z drugiej strony, "dobre" bakterie probiotyczne, takie jak Lactobacillus oraz ich DNA nie generują EMS.
W przypadku E. coli zaobserwowano, że niektóre szczepy wykorzystywane do przenoszenia plazmidów lub klonowania genów także dają wynik ujemny (ryc. 8).
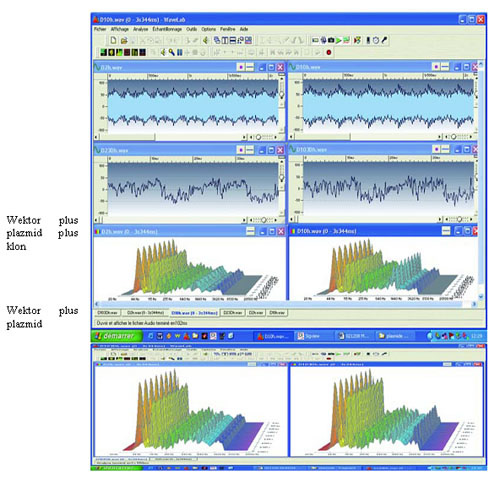
Ryc. 8 EMS wytwarzane przez fragment 1,5 kb adhezyny DNA M. pirum. DNA plazmidu zawierające fragment 1,5 Kb użyto do przekształcenia wektora E. coli ? XL1blue. Całe DNA wyekstrahowano i rozcieńczono w celu przeprowadzenia analizy EMS. Po lewej: kontrolny sygnał tła z ujemnego rozcieńczenia (D 2). Po prawej: sygnał dodatni z rozcieńczenia D 10 (zakres od D 9 do D 12). Na dole: Należy zwrócić uwagę na brak EMS w przypadku DNA wyekstrahowanego ze szczepu przekształconego przez sam plazmid.
Sugeruje to, że tylko niektóre sekwencje DNA powodują generowanie EMS.
Jako że patogenność jest często związana ze zdolnością mikroorganizmu do wiązania komórek eukariotycznych, a zwłaszcza komórek błony śluzowej, autorzy ponownie skoncentrowali swoją analizę na DNA M. pirum, w którym jeden gen (adhezyna: białko 126 kDa) jest odpowiedzialny za adhezję tego prątka do komórek ludzkich.
Gen ten wcześniej sklonowano i poddano sekwencjonowaniu w laboratorium autorów (Tham i wsp., 1994). Sklonowane DNA istniało jako dwa fragmenty w dwóch plazmidach, odpowiadających odpowiednio końcowi N (1,5 Kbp) i końcowi C (5 Kbp) białka.
Dwa plazmidy (pBluescript SK, Stratagene) zawierające fragmenty DNA poddano amplifikacji w szczepie E. coli XL1blue.
Samo DNA tego szczepu E. coli (z plazmidem lub bez plazmidu) nie generuje EMS w żadnym rozcieńczeniu.
Gdy natomiast szczep ten przekształcono przy użyciu plazmidów przenoszących fragment genu adhezyny, EMS były emitowane (ryc. 8)
Dwa fragmenty DNA adhezyny były następnie wycinane swoistymi enzymami restrykcyjnymi (koniec N: 1,5 kbp/SpeI EcoRI) (koniec C: 5 kbp/HindIII-XbaI) i izolowano metodą elektroforezy w 0,8% żelu agarozowym. Każdy fragment DNA był w stanie indukować EMS (dane nie są przedstawione).
Autorzy oczyścili także dużą frakcję DNA adhezyny z całego genomowego DNA prątka przy użyciu swoistych primerów i metody amplifikacji PCR.
Także ten fragment indukował EMS, co wskazuje na to, że nie odgrywało roli zanieczyszczające DNA pochodzące z plazmidu przenoszonego przez E. coli (dane nie są przedstawione).
Omówienie wyników
Autorzy odkryli nową właściwość DNA, mianowicie zdolność pewnych sekwencji do emitowania fal elektromagnetycznych po wzbudzeniu przez tło elektromagnetyczne środowiska.
Na skutek niskiej czułości i swoistości rejestrowania oraz analizy sygnału przez autorów, wszystkie emitowane częstotliwości są podobnie, niezależnie od ocenianego gatunku bakterii.
Jednak eksperymenty związane z przeniesieniem informacji przez plastikowe probówki sugeruje, że poprzez dopracowanie metod analizy i wyeliminowanie zmienności sygnałów wzbudzających możliwe byłoby wykrywanie określonych różnic pomiędzy gatunkami, a nawet pomiędzy sekwencjami. Może wręcz okazać się, że właściwość taka jest wspólna dla wszystkich form DNA tworzących podwójną helisę, w tym także DNA ludzkiego.
Jednak w warunkach wykrywania, jakimi dysponowali autorzy, wydaje się ona związana tylko z niektórymi sekwencjami bakteryjnymi.
W przyszłości należałoby określić, czy są one ograniczone do pewnych genów istotnych dla rozwoju chorób.
Eksperymenty, które zostaną opisane w osobnej pracy, rzeczywiście wskazują na to, że wykrywanie takie może mieć także zastosowanie w skali organizmu ludzkiego: autorzy wykryli takie same EMS w osoczu i DNA wyekstrahowanym z osocza pacjentów z chorobą Alzheimera, chorobą Parkinsona, stwardnieniem rozsianym i reumatoidalnym zapaleniem stawów. Sugerowałoby to, że w chorobach tych występują zakażenia bakteryjne.
Co więcej, EMS można wykryć także w obecności RNA wirusów takich jak HIV, wirus grypy typu A, wirus zapalenia wątroby typu C. W tych przypadkach optymalna filtracja w celu wykrycia EMS wymaga uprzedniej filtracji przez filtr o średnicy porów 20 nm, co sugeruje, że powstające nanostruktury są mniejsze niż w przypadku DNA bakteryjnego.
U pacjentów zakażonych wirusem HIV EMS można wykryć głównie u pacjentów otrzymujących leczenie przeciwretrowirusowe oraz u osób z bardzo niskim mianem wirusa w osoczu. Takie nanostruktury utrzymujące się w osoczu mogą stanowić element rezerwuaru wirusa, który umyka leczeniu przeciwwirusowemu, przy założeniu, że przenoszą one informacje genetyczne wirusa.
Charakter fizyczny nanostruktur, które są źródłem rezonansu EMS, nie został jeszcze określony.
Wiadomo z bardzo wczesnych badań dyfrakcji promieniowania rentgenowskiego DNA, że cząsteczki wody są ściśle związane z podwójną helisą, a każdy początkujący adept biologii molekularnej wie o tym, że DNA w roztworze wodnym tworzy żele wiążące większą liczbę cząsteczek wody.
Co więcej, w szeregu badań fizycznych zaobserwowano, że cząsteczki wody mogą tworzyć długie polimery dipoli powiązanych mostkami wodorowymi (Ruan i wsp., 2004; Wernet i wsp., 2004).
Wydaje się jednak, że połączenia te są bardzo krótkotrwałe (Cowan i wsp., 2005). Czy mogą one utrzymywać się dłużej, podtrzymywane przez emitowane przez nie promieniowanie elektromagnetyczne, jak wcześniej postulowali Del Guidice, Preparata i Vitielo (1988)?
Autorzy zbadali zmniejszanie się w czasie zdolności rozcieńczeń do emitowania EMS po ich odizolowaniu (w pudełkach z mumetalu) od wzbudzającego działania sygnałów tła. Zdolność ta utrzymuje się co najmniej kilka godzin, czasem do 48 godzin, co wskazuje na względną stabilność nanostruktur.
Czy są one wystarczająco swoiste dla sekwencji DNA, aby były w stanie przenosić informacje genetyczne?
Jeżeli tak, to jaka może być ich rola w patogenezie, a zwłaszcza w powstawaniu chorób przewlekłych?
Wyraźnie potrzebne są dalsze badania, prowadzone w ścisłej współpracy pomiędzy fizykami i biologami, w celu udzielenia odpowiedzi na te pytania.
Podziękowania
Dziękujemy dr A. Blanchardowi za nieodpłatne przekazanie DNA Mycoplasma pirum oraz ddr D. Guillonnetowi, R. Olivierowi, L. Thibodeau i J. Varonowi za pomocną dyskusję.
Piśmiennictwo
[1] Benveniste, J., Jurgens, P., A¨issa, J. 1996. Digital recording/ transmission of the cholinergic signal. Faseb Journal 10, A1479.
[2] Benveniste, J., Guillonnet, D. 2003. Method, system and device for producing signals from a substance biological and/or chemical activity. US Patent N? 6 541, 978 B1.
[3] Cowan, M.L., Bruner, B.D., Huse, N., Dwyer, J.R., Chugh, B., Nibbering, E.T., Elsaesser, T., Miller, R.J. 2005. Ultrafast memory loss and energy redistribution in the hydrogen bond network of liquid H2O. Nature 434, 199?202.
[4] David, J. 1998. Introduction to Magnetism and Magnetic Materials. CRC Press. 354.
[5] Del Guidice, E., Preparata, G., Vitielo, G. 1988. Water as a free electric dipole laser. Physical Review Letters 61, 1085?1088.
[6] Grau, O., Kovacic, R., Griffais, R., Montagnier, L. 1993. Development of a selective and sensitive polymerase chain reaction assay for the detection of Mycoplasma pirum. FEMS Microbiology Letters 106, 327?334.
[7] Ruan, C.Y., Lobastov, V.A., Vigliotti, F., Chen, S., Zewall, A.H. 2004. Ultrafast electron crystallography of interfacial water. Science 304, 80?84.
[8] Tham, T.N., Ferris, S., Bahraoui, E., Canarelli, S., Montagnier, L., Blanchard, A. 1994. Molecular characterization of the P1-like adhesin gene from Mycoplasma pirum. Journal of Bacteriology, 781?788.
[9] Tully, J.G., Whitcomb, R.G., Clark, H.F., Williamson, D.L. 1977. Pathogenic mycoplasmas: cultivation and vertebrate pathogenicity of a new spiroplasma. Science 195, 892?894.
[10] Wernet, P., Nordlund, D., Bergmann, U., Cavalleri, M., Odelius, M., Ogasawara, H., N¨aslund, L.A., Hirsch, T.K., Ojam¨ae, L., Glatzel, P., Pettersson, L.G., Nilsson, A. 2004. The structure of the first coordination shell in liquid water. Science 304, 995?999.


